Micorrizas (FMA) - tudo o que você precisa saber
O termo micorriza foi criado pelo botânico alemão Albert Bernard Frank, em 1885 e vem do grego, em que "mico" significa fungo e "riza" raízes.

Índice de conteúdos - clique para navegar
O que são micorrizas
Benefícios das micorrizas
- Melhor absorção de nutrientes e água
- Aumento da resistência a doenças
- Recuperação de áreas degradadas
- Sequestro de carbono
Classificação das micorrizas
Como ocorre a formação de micorrizas
Aplicação de micorrizas
- Fatores que afetam a colonização de micorrizas
Inoculantes com micorrizas
- Formulações
- Produção em substrato sólido
- Sistemas hidropônicos e aeropônicos
- Sistema de cultivo de raízes in vitro
- Sistema de cultivo em biorreator
Uso de micorrizas na soja
O que são micorrizas
O termo micorriza foi criado pelo botânico alemão Albert Bernard Frank, em 1885 e vem do grego, em que "mico" significa fungo e "riza" raízes. Com esta tradução podemos ter uma boa ideia inicial de como funcionam as micorrizas. Estes organismos atuam como associações simbióticas entre as raízes na maioria das plantas terrestres e fungos do solo (Santos, 2006; Kistner & Parniske, 2002). Esta associação proporciona o aumento da capacidade de absorção de nutrientes e água da planta, através da expansão da área explorada pelas raízes (Moreira & Siqueira, 2006), reduzindo a necessidade de fertilizantes no solo, contribuindo para uma agricultura mais sustentável.
As micorrizas melhoram a eficiência de exploração do solo pelas plantas, pois desenvolvem uma rede extraradicular formada pelo micélio, conectada com as raízes, que se estende pelo solo por vários centímetros, fazendo com que as plantas explorem um volume de solo muito maior. Diversos estudos relacionam aumentos significativos de produtividade em solos com micorrizas quando comparados a solos sem micorrizas. Abaixo você irá entender quais os benefícios que estes organismos proporcionam e como isso influencia nas produtividades.
Benefícios das micorrizas
Melhor absorção de nutrientes e água
O maior volume de solo explorado pelas micorrizas aumenta significativamente a quantidade absorvida de alguns nutrientes, inclusive o fósforo, um elemento que é bastante retido pelo solo e muitas vezes as plantas possuem dificuldades para absorve-lo (Raven et al., 1996; Souza et al; 2011). As hifas das micorrizas são muito mais eficientes para absorver e transportar fósforo do solo até as raízes do que o sistema radicular das plantas (Smith & Read, 2008). Esta melhor absorção de alguns nutrientes ocorre, pois, a grossura das hifas da micorriza é bem menor do que a grossura das raízes, e devido a esta diferença de tamanho, as hifas conseguem acessar poros menores no solo, inacessível às raízes, absorvendo água e nutrientes retidos nestes poros e transferindo-os para as plantas (Sampaio, 2012). Segundo Marschner & Dell (1994), a hifa da micorriza pode fornecer 80% do fósforo, 25% do nitrogênio, 10% do potássio, 25% do zinco e 60% do cobre.
A soja possui grande importância econômica na região dos Cerrados, e é altamente dependente da aplicação de fósforo. Lopes & Siqueira (1981) estimaram que as micorrizas aumentam cerca de 15% na eficiência de absorção desse nutriente. Além disso, as micorrizas possuem grande importância na nodulação de bactérias fixadoras de nitrogênio em culturas leguminosas. Em solos tropicais, deficientes de nitrogênio e fósforo, a interação positiva entre fungos micorrízicos arbusculares possui grande importância, pois a fixação biológica do nitrogênio depende de uma nutrição equilibrada da planta hospedeira, principalmente em fósforo, nutriente que é muito absorvido pelas micorrizas nas plantas (Faria, 1998). Dados de pesquisas mostram que até 80% do crescimento da soja pode depender da associação com fungos micorrízicos arbusculares.
Observe na imagem abaixo, em estudo realizado por Jeanne Miranda et al. (2005), a importância das micorrizas em algumas espécies. Na direita (I0) planta de mandioca não inoculada com micorriza, comparada com plantas inoculadas com diferentes espécies de micorrizas (I1, I2 e I3).

Fotos: Jeanne Miranda / EMBRAPA
Aumento da resistência a doenças
Outro benefício das micorrizas é a possibilidade de aumento da resistência das plantas aos patógenos radiculares (Nogales et al., 2009). Conforme Sikes et al. (2009), ocorrem alterações morfológicas nas raízes das plantas que estão associadas com micorrizas. Para as micorrizas estarem em simbiose com a planta, estas ocupam os sítios de infecção das raízes, reduzindo os locais de infecção para patógenos que trazem doenças.
Outro fator importante é que plantas bem nutridas possuem maior resistência ao ataque de pragas e doenças, e neste aspecto, as micorrizas contribuem para a nutrição vegetal.
Recuperação de áreas degradadas
Alguns estudos evidenciam a importância do uso de micorrizas arbusculares para recuperar áreas degradadas, através da reintrodução de propágulos selecionados, proporcionando às espécies vegetais melhor acesso à água e nutrientes, principalmente ao fósforo, e melhor resistência à estresses bióticos e abióticos. Neste aspecto, é importante conhecer quais são as espécies de micorrizas mais tolerantes à condições de estresse, que irão apresentar melhores benefícios nessas áreas (Colodete et al., 2014; Mergulhão et al., 2014).
Existem diversos relatos de diminuição da fotossíntese em plantas causada por metais no solo, que causam alterações na fisiologia das plantas e biodiversidade do solo. Os fungos ectomicorrizícos associado a espécies vegetais possui potencial bioacumulador destes metais (Nogueira & Soares, 2010). Assim, as micorrizas se apresentam como uma ótima ferramenta para o restabelecimento de vegetação em ecossistemas degradados ou debilitados, conservando a biodiversidade e funcionamento do ecossistema.
Sequestro de carbono
O micélio dos fungos micorrízicos também agrega as partículas do solo, e atua no processo de armazenamento de carbono no solo através da produção de glomalina (Wright, 2005), uma proteína pegajosa, componente da matéria orgânica, que retém aproximadamente 27% do seu carbono total, sendo considerada um fator expressivo de sequestro de carbono no solo (Cornis, 2002), e redução de gases de efeito estufa para a atmosfera, visto que é estável no solo (Rillig et al., 2001). As micorrizas podem conter até 20 vezes mais carbono do que a biomassa microbiana.
Além disso, a glomalina contribui para a formação e estabilidade de agregados, favorecendo a aeração, infiltração e armazenamento de água, além de estimular as trocas gasosas do solo e o crescimento das raízes.
Classificação das micorrizas
Originalmente, as micorrizas são classificadas em 3 grupos conforme a sua morfologia e anatomia (Siqueira & Franco, 1988):
- Endomicorrizas: são chamadas também de fungos micorrízicos arbusculares (FMA), sendo as mais comuns. As hifas do fungo penetram nas células corticais da raiz, sem provocar deformações e sem formar manto externo de hifas. Proporcionam benefícios como absorção de nutrientes como nitrogênio, fósforo, zinco e cobre, além de favorecer a fixação biológica de nitrogênio e a tolerância a estresses diversos;
- Ectomicorrizas: as hifas crescem de maneira intercelular (fora das células), formando manto de hifas ao redor da raiz. Proporciona benefícios como absorção de nutrientes com nitrogênio e fósforo, e tolerância a estresses bióticos (doenças) e abióticos (como por exemplo frio e seca);
- Ectoendomicorrizas: apresentam características tanto de ectomicorrizas como de endomicorrizas.
Como ocorre a formação de micorrizas
A maioria das culturas possuem suas raízes colonizadas naturalmente por fungos micorrízicos arbusculares, e o seu teor aumenta com o uso de práticas agrícolas como preparo do solo, calagem, adubação, sistemas de plantio, adubação verde, rotação de culturas etc.
As associações simbióticas ocorrem inicialmente com a germinação de esporos, nos segmentos da raiz infectada ou das próprias hifas de fungo no solo. Então, ocorre a proliferação das hifas da micorriza e diferenciação fúngica, ocorrendo em seguida a penetração na raiz da planta e colonização de estruturas. Nesta associação, a planta fornece carboidratos e proteção para o fungo, e o fungo aumenta a capacidade de absorção de nutrientes minerais da planta, favorecendo o seu desenvolvimento (Souza et al., 1998).
A germinação de fungos micorrízicos é regulada por fatores físicos e químicos do solo e estímulos provocados por exsudatos das raízes (Zambolim & Siqueira, 1985; Romero, 1999). Matéria orgânica, teores de fósforo e potássio e pH do solo são determinantes no sucesso da colonização das raízes e formação de esporos de micorrizas (Nunes, 2007). Além disso, as micorrizas também aumentam a tolerância das plantas aos metais pesados, através da agregação de partículas e retenção nas raízes, diminuindo a translocação para a parte aérea (Viana & Santos, 2010; Cabral et al., 2010).
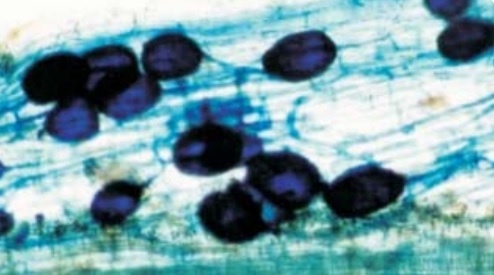
Raízes de manga colonizadas por micorrizas. Na imagem hifas internas e vesículas.
Foto: Valter Lopes / EMBRAPA
Aplicação de micorrizas
A aplicação de micorrizas em grandes áreas é feita através da inoculação, sendo fundamental o uso de inoculantes de qualidade, com alta densidade de propágulos. Porém, o desenvolvimento desses organismos é complexo e assíncrono, e assim, é fundamental o conhecimento sobre a capacidade de espécies vegetais em formar a simbiose com os fungos. A eficiência da simbiose depende da compatibilidade genética entre o fungo e a planta para uma determinada condição. Diversos estudos apontam que no Brasil as espécies do gênero Glomus são as mais efetivas para o desenvolvimento de gramíneas.
Observe a tabela abaixo com alguns exemplos de culturas que favorecem ou não o desenvolvimento de micorrizas:
| Culturas | Esporos (nº 50/g)* |
| Feijão-de-porco | 67 |
| Mamona | 47 |
| Milho | 53 |
| Girassol | 20 |
| Arroz | 4 |
| Pousio | 4 |
*Dados transformados em y= (x + 0,5)0,5 para fins da análise estatística.
Fonte: Miranda et al., 2001.
| Adubos verdes | Colonização radicular (%) |
| Crotalária | 49 |
| Guandu | 52 |
| Feijão-bravo-do-ceará | 60 |
| Girassol | 51 |
| Milheto | 49 |
| Mucuna | 49 |
| Nabo forrageiro | 0 |
Fonte: Miranda & Miranda, 2006
A produção comercial de inoculante com fungos micorrízicos deve ser feita com organismos com sua eficiência comprovada em condições de campo, ou com os organismos mais comuns dentro de um determinado ecossistema ou região, que serão os organismos adaptados para o uso nestes locais (Stürmer e Siqueira, 2006). O sucesso da inoculação depende, principalmente, da compatibilidade do fungo micorrízico com a planta hospedeira.
Miranda & Miranda (2001), após diversos estudos realizados com culturas anuais e forrageiras em vasos, chegaram a conclusão que as espécies de micorrizas Glomus etunicatum, Entrosphora colombiana e Glomus manihotis são as que apresentaram melhores resultados em produtividade. O uso destas espécies em substratos, para produção de mudas, beneficia o desenvolvimento de diversas plantas em diferentes condições de acidez e fertilidade.
Fatores que afetam a colonização de micorrizas
- pH do solo: geralmente as micorrizas germinam na faixa de pH favorável à maioria das plantas. Micorrizas dos gêneros Gigaspora e Acaulospora geralmente germinam em solos com pH ácido, já as do gênero Glomus preferem pH neutro a alcalino. Observe a tabela abaixo
Fonte: Adaptado de Sieverding, 1991Tabela 3. Ocorrência diferenciada de espécies de fungos micorrízicos arbusculares nativos em função do pH de solos naturais de regiões tropicais. pH < 5,5 pH > 5,5 pH 4,0 - 8,0 Entrophospora colombiana Glomus mosseae Acaulospora longula Gigaspora margarita Acaulospora morrowae Acaulospora myriocarpa Acaulospora scrobiculata Glomus aggregatum Glomus versiforme Scutellospora pellucida
-
Umidade do solo: em solos secos, a germinação de esporos é reduzida. Algumas espécies germinam melhor com umidade igual ou superior à capacidade de campo, já outras são prejudicadas com a umidade superior à capacidade de campo. Deve ser avaliada cada espécie em questão.
- Temperatura: micorrizas dos gêneros Glomos e Acaulospora normalmente possuem como temperatura mínima para germinação a faixa entre 10ºC e 18ºC, temperatura máxima de 30ºC e uma faixa ótima entre 20ºC e 25ºC. Já o gênero Gigaspora se desenvolve em temperaturas superiores.
A faixa de temperatura ideal para o desenvolvimento das micorrizas é relacionada ao local de origem destas, assim, entende-se que as micorrizas podem se adaptar a diversas temperaturas. - Luminosidade: aumento da intensidade luminosa e fotoperíodos longos (acima de 12 horas) aumentam a porcentagem de colonização das micorrizas. Já a redução da intensidade luminosa e nas horas de luz desfavorecem a colonização, mas favorecem a produção de esporos.
- Substratos de cultivo: geralmente as micorrizas se desenvolvem melhor em misturas de dois ou mais substratos, diminuindo em meios de cultivo com apenas um substrato. Deve-se observar também características dos substratos como o conteúdo de nutrientes, pH e matéria orgânica.
- Adubação:
- Adubos orgânicos: o uso de adubos orgânicos, quando seu teor no solo é baixo, pode melhorar o desenvolvimento das micorrizas. Já quando é feito um uso excessivo de adubo orgânico, pode ocorrer um efeito negativo sobre a colonização e produção de esporos das micorrizas.
- Adubos nitrogenados: os adubos nitrogenados na forma de amônio possuem um efeito mais inibitório às micorrizas do que em outras formas.
- Nível de fósforo no solo: teores de fósforo no solo acima do nível requerido pelas plantas pode prejudicar a produção de esporos e colonização das micorrizas.
- Biocidas: o uso de agrotóxicos para eliminar patógenos do solo / substrato pode eliminar também os microrganismos benéficos, como as micorrizas (Souza et al., 2002). Nos últimos anos, os cultivos vêm enfrentando diversos problemas fitossanitários causados por fungos e bactérias. Por isto, é comum o uso de defensivos e fertilizantes químicos;
- Outros fatores: fatores como a monocultura, pousio, uso de culturas sem dependência micorrízica e construção civil ou mineração tendem a reduzir a população de micorrizas.
Inoculantes com micorrizas
Os diferentes métodos abaixo possuem vantagens e desvantagens. Deve-se considerar aspectos como tempo de cultivo, pH do substrato / solução, espécie de micorriza, interações e recomendações entre espécies e plantas. Também deve-se considerar o custo de produção, espaço, eficiência da associação e disponibilidade de mão-de-obra qualificada.
Formulações
Existem diversos produtos feitos à base de micorrizas com diferentes formulações (granular, líquida, pó seco e solúvel), recomendados para diversas culturas agrícolas. Os produtos podem ser feitos com propágulos puros, misturas de diferentes espécies de micorrizas, além de bactérias ou fungos de outros filos.
Produção em substrato sólido
Além disso, as micorrizas podem ser produzidas em substratos sólidos. Para isso, é necessário um recipiente livre de propágulos, um substrato esterilizado e uma planta cuja espécie estimule a esporulação da espécie de micorriza. Então, usa-se um inóculo da micorriza de qualidade, que pode ser obtido de coleções como a Coleção Internacional de Culturas de Glomeromycota (CICG). Este método é de fácil aplicabilidade, porém é limitado pelo volume de substrato necessário e necessidade de grandes espaços para a produção em vasos ou bandejas. Também podem ocorrer limitações pela luminosidade necessária, controle de temperatura e possibilidade de contaminação por ar ou insetos carregados com propágulos das micorrizas.
Sistemas hidropônicos e aeropônicos
As mudas são pré-cultivadas e inoculadas em recipientes e substratos livres de propágulos de fungos. Avalia-se a colonização pela micorriza, e em caso positivo, transfere-se a muda para um sistema hidropônico. Deve-se ajustar a solução nutritiva, pois alguns nutrientes, como o fósforo, podem inibir a colonização das micorrizas. No caso da aeroponia, o fornecimento de nutrientes é feito através de pulverização.
Sistema de cultivo de raízes in vitro
É feito usando raízes ou esporos contendo estruturas de micorrizas, desinfetados e transferidos para meios de cultura em placas de Petri com raízes transformadas com Agrobacterium rhizogenes. O meio de cultura é formado por elementos como sódio, nitrogênio, fósforo, zinco, manganês, sacarose, ágar e antibióticos. Porém, o sucesso desse método ainda deve ser avaliado por pesquisas. Alguns estudos mostram a menor eficiência deste método quando comparado à produção in vivo.
Sistema de cultivo em biorreator
Usa-se raízes transformadas pré-inoculadas em placas de Petri, que são inseridas em biorreator aerado ou agitado, e suspensas em solução nutritiva com antibióticos e substâncias que estimulam o crescimento das micorrizas e das raízes.
Nos sistemas hidropônico, aeropônico, placas de Petri e biorreator, o produto são raízes sanitizadas e colonizadas com as micorrizas, que podem ser desidratadas e misturadas com materiais inertes para formular um produto. Nos sistemas fechados, o controle de contaminação é mais fácil, porém são mais caros e complexos.
Uso de micorrizas (FMA) na soja
Diversos estudos foram feitos com o objetivo de entender os benefícios das micorrizas na cultura da soja, observe a tabela abaixo:
| Espécie de FMA | Principais resultados | Referências |
| FMA autóctones Claroideoglomus etunicatum, Fonneliformis mosseae, Glomus macrocarpum e Rhizophagus intraradices |
Aumento do crescimento, rendimento e acúmulo de fósforo | Adeyemi et al. (2020), Adeyemi et al. (2021), Faggioli et al. (2020); Nogueira; Cardoso (2002), Stoffel et al. (2020a) |
| G. etunicatum e G. fasciculatum | Maior tolerância à acidez do solo | Maddox; Soileau (1991). |
| G. etunicatum, G. macrocarpum, Gigaspora margarita e R. intraradices | Redução da toxicidade de metais (Pb, Mn) nas plantas | Andrade; Silveira (2004), Andrade et al. (2003), Manara (2012), Nogueira; Cardoso (2000), Nogueira; Cardoso (2003), Spagnolett et al. (2017). |
| FMA autóctones e G. macrocarpum | Interação positiva com a comunidade autóctone, aumento da atividade biológica do solo | Andrade; Silveira (2004), Hoeksema et al. (2010) |
| C. etunicatum, Dentiscutata heterogama e R. clarus | Melhor crescimento inicial da soja e acúmulo de nutrientes com aplicação de formononetina | Salgado et al (2016). |
| G. clarum, G. etunicatum, G. fasciculatum, G. macrocarpum, G. margarita e R. intraradices | Sinergia com bactérias fixadoras de N, maior crescimento da soja, nodulação, acúmulo de fósforo e nitrogênio e produção de açúcares | Adeyemi et al. (2021), Bidondo et al. (2011), Clua et al. (2013), Harris et al. (1985), Pereira et al. (2013), Püschel et al. (2017), Silva et al. (2017). |
| FMA autóctones | Aumento da colonização micorrízica e biomassa de raízes, e aumento de fungos promotores de crescimento das plantas. | Farias et al. (2018). |
| F. mosseae e R. intraradices | Proteção contra doenças de raízes e parte aérea. | Giachero et al. (2017), Jie et al. (2019), Leigh et al. (2011), Li et al. (2013), Qian et al. (2015), Sastrahidayat et al. (2011), Spagnolett et al. (2017). |
Fonte: STOFFEL et al. (2022).
A soja é uma planta altamente responsiva às micorrizas, com respostas principalmente em aumento de crescimento e acúmulo de fósforo e aumentar a tolerância à acidez, porém, conforme mencionado acima, a contribuição das micorrizas podem proporcionar diversas vantagens, mas estas dependem de diversos outros fatores como as espécies simbiontes, condições climáticas, condições do solo, disponibilidade de água etc.
Anderson Wolf Machado - Engenheiro Agrônomo
Referências:
ADEYEMI, N. O.; ATAYESE, M. O.; SAKARIYAWO, O. S.; AZEEZ, J. O.; OLUBODE, A. A.; RIDWAN, M.; ADEBIYI, A.; ONI, O.; IBRAHIM, I. Influence of different arbuscular mycorrhizal fungi isolates in enhancing growth, phosphorus uptake and grain yield of soybean in a phosphorus deficient soil under field conditions. Communications in Soil Science and Plant Analysis, v. 52, n. 10, p. 1171-1183, 2021.
ADEYEMI, N. O.; ATAYESE, M. O.; OLUBODEB, A. A.; AKAN, M. E. Effect of commercial arbuscular mycorrhizal fungi inoculant on growth and yield of soybean under controlled and natural field conditions. Journal of Plant Nutrition, v. 43, n. 4, p. 487-499, 2020.
ANDRADE, S. A. L.; ABREU, C. A.; ABREU, M. F.; SILVEIRA, A. P. D. Interaction between lead, soil base saturation rate, and mycorrhiza on soybean development and mineral nutrition. Revista Brasileira de Ciência do Solo, v. 27, n. 5, p. 945-954, 2003.
ANDRADE, S. A. L.; SILVEIRA, A. P. D. Biomassa e atividade microbiana do solo sob influência de chumbo e da rizosfera da soja micorrizada. Pesquisa Agropecuária Brasileira, v. 39, n. 12, p. 1191-1198, 2004.
BIDONDO, L. F.; SILVANI, V.; COLOMBO, R.; PÉRGOLA, M.; BOMPADRE, J.; GODEAS, A. Pre-symbiotic and symbiotic interactions between Glomus intraradices and two Paenibacillus species isolated from AM propagules. In vitro and in vivo assays with soybean (AG043RG) as plant host. Soil Biology and Biochemistry, v. 43, n. 9, p. 1866-1872, 2011.
CABRAL, L.; SIQUEIRA, J. O.; SOARES, C. R. F. S.; PINTO, J. E. B. P. Retenção de metais pesados em micélio de fungos micorrízicos arbusculares. Química Nova, v. 33, n.1, 2010.
CLUA, A.; OLGIATI, J.; BELTRANO, J. Evaluación de la doble inoculación Bradyrhizobium-micorrizas y el uso de fitoterápicos de semilla en el crecimiento, eficiencia de inoculación y el rendimiento de un cultivo de soja. Revista de Investigaciones Agropecuarias, v. 39, n. 3, p. 250-258, 2013.
COLODETE C. M.; DOBBSS L. B.; RAMOS, A. C. Aplicação das Micorrizas arbusculares na recuperação de áreas impactadas. Natureza on line, v. 12, n. 1, p. 31-37, 2014.
CORNIS, D. Glomalin, hiding place for a third of the world’s stored soil carbon. Agricultural Research, Washington, v. 50, n. 9, p. 4, 2002.
FAGGIOLI, V. S.; MARTA, C.; MARIANA, M. N.; FERNANDA, C. Contribución de hongos micorrícicos nativos a la nutrición fosforada y su impacto en la partición de fotoasimilados de soja. Ciencia del Suelo, v. 38, n. 1, p. 81-94, 2020
FARIA, F. C. Efeito de associações micorrízicas na eficiência e competitividade de estirpes de rizóbio no feijoeiro. 1998. 105 p. Dissertação (Mestrado) - Universidade de Brasília, Brasília.
FARIAS, C. P.; CARVALHO, R. C.; RESENDE, F. M. L.; AZEVEDO, L. C. B. Consortium of five fungal isolates conditioning root growth and arbuscular mycorrhiza in soybean, corn, and sugarcane. Anais da Academia Brasileira de Ciências, v. 90, n. 4, p. 3649-3660, 2018.
GIACHERO, M. L.; MARQUEZ, N.; GALLOU, A.; LUNA, C. M.; DECLERCK, E.; DUCASSE, D. A. An in vitro method for studying the three-way interaction between soybean, Rhizophagus irregularis and the soil-borne pathogen Fusarium virguliforme. Frontiers in Plant Science, v. 8, n. 1033, 2017
GIANINAZZI, S.; TROUVELOT, A.; GIANINAZZI, V. Role and use of mycorrhizas in horticultural crop production, 23 I.H.C. Plenary Lectures, London, v. 32, p.25-30, 1990.
HARRIS, D.; PACOVSKY, R. S.; PAUL, E. A. Carbon economy of soybean rhizobium-glomus associations. New Phytologist, v. 101, n. 3, p. 427-440, 1985.
HOEKSEMA, J. D.; CHAUDHARY, V. B.; GEHRING, C. A.; JOHNSON, N. C.; KARST, J.; KOIDE, R. T.; PRINGLE, A.; ZABINSKI, C.; BEVER, J. D.; MOORE, J. C.; WILSON, G. W. T.; KLIRONOMOS, J. N.; UMBANHOWAR, J. A meta-analysis of context-dependency in plant response to inoculation with mycorrhizal fungi. Ecology Letters, v. 13, p. 394-407, 2010.
JIE, W.; LIN, J.; GUO, N.; CAI, B.; YAN, X. Community composition of rhizosphere fungi as affected by Funneliformis mosseae in soybean continuous cropping soil during seedling period. Chilean Journal of Agricultural Research, v. 79, n. 3, p. 356-365, 2019.
Kistner, C. & Parniske, M. Evolution of signal transduction in intracellular symbiosis. Trends in Plant Science, 7(11):511-518. 2002.
LEIGH, J.; FITTER, A. H.; HODGE, A. Growth and symbiotic effectiveness of an arbuscular mycorrhizal fungus in organic matter in competition with soil bacteria. FEMS Microbial Ecology, v. 76, n. 3, p. 428-438, 2011.
LI, Y.; LIU, Z.; HOU, H.; LEI, H.; ZHU, X.; LI, X.; HE, X.; TIAN, C. Arbuscular mycorrhizal fungi-enhanced resistance against Phytophthora sojae infection on soybean leaves is mediated by a network involving hydrogen peroxide, jasmonic acid, and the metabolism of carbon and nitrogen. Acta Physiologiae Plantarum, v. 35, p. 3465-3475, 2013.
LOPES, E. S.; SIQUEIRA, J. O. Vesicular-arbuscular mycorrhizas: their potencial in phosphate nutrition in tropical regions. In: RUSSEL, R. S.; IGUE, K.; MEHTA, Y. R. (Ed.). The soil-root system in relation to brazilian agriculture. Londrina: IAPAR, 1981. p. 225-242.
MANARA, A. Plant responses to heavy metal toxicity. In: FURINI, A. Plants and Heavy Metals: Springer Briefs in Molecular Science. Dordrecht: Springer, 2012.
MARSCHNER, H.; DELL, B. Nutrient uptake in mycorrhizal symbiosis. Plant and Soil, v. 159, p. 89-102, 1994.
MERGULHÃO, A. C. E. S.; SIVA, M. V. da; LYRA, M. C. C. P. de; FIGUEIREDO, M. V. B.; SILVA, M. L. R. B. da; MAIA, L. C. Caracterização morfológica e molecular de fungos micorrízicos arbusculares isolados de áreas de mineração de gesso, Araripina, PE, Brasil. Hoehnea. v. 41, n. 3, p. 393-400, 2014.
MIRANDA, J. C. C.; MIRANDA, L. N. Seleção e recomendação de uso de espécies de fungos micorrízicos arbusculares. Planaltina, DF: Embrapa Cerrados, 2001. 3 p. (Embrapa Cerrados. Comunicado Técnico, 52).
MIRANDA, J. C. C.; MIRANDA, L. N.; VILELA, L.; VARGAS, M. A.; CARVALHO, A. M. Manejo da micorriza arbuscular por meio da rotação de culturas nos sistemas agrícolas do cerrado. Planaltina, DF: Embrapa Cerrados, 2001. 3 p. (Embrapa Cerrados. Comunicado Técnico, 42).
MOREIRA, F. S.; SIQUEIRA, J. O. Microbiologia e bioquímica do solo. 2. ed. Lavras: Ed. da UFLA, 2006.
NOGALES, A.; AGUIRREOLEA, J.; MARIA, E. S.; CAMPRUBI, A.; CALVET, C. Response of mycorrhizal grapevine to Armillaria mellea inoculation: disease development and polyamines. Plant and Soil, v. 317, p.177-187, 2009.
MADDOX, J. J.; SOILEAU, J. M. Effects of phosphate fertilization, lime amendments and inoculation with VA–mycorrhizal fungi in soybeans in an acid soil. Plant and Soil, v. 134, p. 83-93, 1991.
NOGUEIRA, M. A.; CARDOSO, E. J. B. N. Mycorrhizal effectiveness and manganese toxicity in soybean as affected by soil type and endophyte. Scientia Agricola, v. 60, n. 2, p. 329-335, 2003.
NOGUEIRA, M. A.; CARDOSO, E. J. B. N.. Produção de micélio externo por fungos micorrízicos arbusculares e crescimento da soja em função de doses de fósforo. Revista Brasileira Ciência do Solo, v. 24, n. 2, p. 329-338, 2000.
NOGUEIRA, M. A.; CARDOSO, E. J. B. E. Interações microbianas na disponibilidade e absorção de manganês por soja. Pesquisa Agropecuária Brasileira, v. 37, n. 11, p. 1605-1612, 2002.
NOGUEIRA, M. A.; SOARES, C.R.F.S. Micorrizas arbusculares e elementos-traço. In: SIQUEIRA, J.O.; SOUZA, F. A.; CARDOSO, E.J.B.N.; TSAI, S. M. (Org.). Micorrizas: 30 anos de pesquisas no Brasil. Lavras: Editora UFLA, 2010. 716p.
NUNES, J. L. da S. UTILIZAÇÃO DE FUNGOS MICORRÍZICOS ARBUSCULARES AUTÓCTONES DE POMARES DE PESSEGUEIRO PARA PRODUÇÃO DE MUDAS E ESTABELECIMENTO EM ÁREAS NOVAS E DE REPLANTIO. Orientador: Paulo Vitor Dutra de Souza. 2007. Tese (Doutor em Fitotecnia) - Faculdade de Agronomia, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, 2007.
PEREIRA, M. O. G.; SANTOS, C. E. R. S.; FREITAS, A. D. S.; STAMFORD, N. P.; ROCHA, G. S. D. C.; BARBOSA, A. T. Interações entre fungos micorrízicos arbusculares, rizóbio e actinomicetos na rizosfera de soja. Revista Brasileira de Engenharia Agrícola e Ambiental, v. 17, n. 12, p. 1249- 1256, 2013.
PÜSCHEL, D.; JANOUŠKOVÁ, M.; VORÍŠKOVÁ, A.; GRYNDLEROVÁ, H.; VOSÁTKA, M.; JANSA, J. Arbuscular mycorrhiza stimulates biological nitrogen fixation in Two Medicago spp. through improved phosphorus acquisition. Frontiers in Plant Science, v. 8, n. 390, p. 1-12, 2017.
QIAN, L.; YU, W. J.; CUI, J. Q.; JIE, W. G.; CAI, B. Y. Funneliformis mosseae affects the root rot pathogen Fusarium oxysporum in soybeans. Acta agricultura e Scandinavica - Soil and plant science, v. 65, n. 4, p. 321-328, 2015.
Raven, P. H.; Evert, R. F.; Eichhorn, S. E. Biologia vegetal. 5.ed. Rio de Janeiro: Guanabara Koogan S.A., 1996. 728p
RILLIG, M. C.; WRIGHT, S. F.; NICHOLS, K. A.; SCHMIDT, W. F.; TORN, M. S. Large contribution of arbuscular mycorrhizal fungi to soil carbon pools in tropical forest soils. Plant and Soil, The Hague, v. 233, p. 167-177, 2001.
ROMERO, A.G.F. Avaliação agronômica de formulações de isoflavonóide estimulante da micorrização no milho (Zea mays L.). Lavras: Universidade Federal de Lavras, 1999. 40 f. Dissertação (Mestrado em Fitotecnia) - Programa de Pós-Graduação em Agronomia, Universidade Federal de Lavras, Lavras, 1999.
SALGADO, F. H. E. M.; MOREIRA, F. M. S.; PAULINO, H. B.; SIQUEIRA, J. O.; CARNEIRO, M. A. C. Arbuscular mycorrhizal fungi and mycorrhizal stimulant affect dry matter and nutrient accumulation in bean and soybean plants. Pesquisa Agropecuária Tropical, v. 46, n. 4, p. 367-373, 2016.
SAMPAIO, A. M. N. C. O papel das micorrizas no modo de produção biológico da alface (Lactuca sativa L.). 2012. 84 f. Dissertação (Mestrado em Agricultura Biológica) - Escola Superior Agrária do Instituto Politécnico de Viana do Castelo, Portugal, 2012.
SANTOS, L. C. Efeito do cobre na população de bactérias e fungos do solo, associação ectomicorrízica e no desenvolvimento de mudas de Eucalipto e Canafístula. Dissertação de Mestrado. Mestrado em Ciências do Solo, Universidade Federal de Santa Maria (UFSM), Santa Maria, RS. 2006.
SASTRAHIDAYAT, I. R.; DJAUHARI, S.; SALEH, N.; MUHIBUDDIN, A. Control of “damping off” disease caused by Sclerotium rolfsii Sacc. using actinomycetes and VAM fungi on soybean in the dry land based on microorganism diversity of rhizosphere zone. Agrivita, v. 33, n. 1, p. 40-46, 2011.
SIEVERDING, E. Vesicular-arbuscular mycorrhiza management in tropical agrosystems. Eschborn: Deutsche Gesellschaft für Technische Zusammenarbeit, 1991. 371 p.
SILVA, J. S.; CARVALHO, T. S.; SANTOS, J. V.; RIBEIRO, P. R. A.; MOREIRA, F. M. S. Formononetin stimulates mycorrhizal fungi colonization on the surface of active root nodules in soybean. Symbiosis, v. 71, p. 27-34, 2017.
SILVEIRA, S.V. Influência de Fungos Micorrízicos Arbusculares em Mudas de Abacateiro (Persea sp.). 1999. 95 f. Dissertação (Mestrado) - Programa de Pós-Graduação em Fitotecnia, Faculdade de Agronomia, Universidade Federal do Rio Grande do Sul, Porto Alegre, 1999.
Siqueira, J. O.; Franco, A. A. Biotecnologia do solo: fundamentos e perspectivas. Brasília: MEC/ABEAS/ESAL/FAEPE, 1988, 236p
SMITH, S. E.; READ, D. J. Mycorrhizal symbiosis. 3. ed. Boston: Academic Press, 2008. 787 p.
SPAGNOLETTI, F.; CARMONA, M.; GOMEZ, N. E. T.; CHIOCCHIO, V.; LAVADO, R. S. Arbuscular mycorrhiza reduces the negative effects of M. phaseolina on soybean plants in arsenic-contaminated soils. Applied Soil Ecology, v. 121, p. 41-47, 2017.
SOUZA, F. A.; GOMES, E. A.; VASCONCELOS, M. J. V.; SOUSA, S. M. Micorrizas arbusculares: perspectivas para aumento da eficiência de aquisição de fósforo (P) em Poaceae (gramíneas). Sete Lagoas: Embrapa Milho e Sorgo, 2011.
SOUZA, P.V.D. de; ABAD, M.; ALMELA, V. et al. Efecto de Substrato de Cultivo y Hongos micorrízicos Arbusculares Sobre el Desarrolo Vegetativo y el Contenido en Carbohidratos em Plantas de Citrange Troyer injertadas de mandarina Marisol. Revista Brasileira de Fruticultura, Cruz das Almas, v. 20, n. 2, p. 235 – 245, 1998
SOUZA, P.V.D. de; SCHIMITZ, J.A.; FREITAS, R.S. de; CARNIEL, E.; CARRENHO, R. Identificação e quantificação de fungos micorrízicos arbusculares autóctones em municípios produtores de citros no Rio Grande do Sul. Ciência Rural, Santa Maria, v. 37, n. 4, p. 553 – 558, 2002.
Souza, Vênia C. de et al. Estudos sobre fungos micorrízicos. Revista Brasileira de Engenharia Agrícola e Ambiental [online]. 2006, v. 10, n. 3, pp. 612-618. Disponível em: <https://doi.org/10.1590/S1415-43662006000300011>. Epub 06 Fev 2007. ISSN 1807-1929. https://doi.org/10.1590/S1415-43662006000300011.
STOFFEL, S. C. G.; SOARES, C. R. F. S.; GIACHINI, A. J.; LOVATO, P. E. Inoculantes micorrízicos arbusculares para a cultura da soja. In: MEYER, M. C.; BUENO, A. de F.; MAZARO, S. M.; SILVA, J. C. da. Bioinsumos na cultura da soja. 1. ed. Brasília, DF: [s. n.], 2022. cap. 10, p. 181-198.
STOFFEL, S. C. G.; SOARES, C. R. F. S.; MEYER, E.; LOVATO, P. E.; GIACHINI, A. J. Yield increase of soybean inoculated with a commercial arbuscular mycorrhizal inoculant in Brazil. African Journal of Agricultural Research, v. 16, n. 5, p. 702-713, 2020a.
STÜRMER, S. L.; SIQUEIRA, J. O. Diversity of arbuscular mycorrhizal fungi in Brazilian ecosystems. In: MOREIRA, F. M. S.; SIQUEIRA, J. O.; BRUSSAARD, L. (Ed.). Soil biodiversity in Amazonian and other Brazilian ecosystems. Wallingford: CABI-Publications, 2006. p. 206-236.
VIANA, J. H. M.; SANTOS, E. D. A fração glomalina e a estabilidade de agregados de diferentes Latossolos. In: REUNIÃO BRASILEIRA DE MANEJO E CONSERVAÇÃO DO SOLO E DA ÁGUA, 18., 2010. Anais eletrônicos... Disponível em: <http://ainfo.cnptia.embrapa.br/digital/bitstream/item/29839/1/Fracao-glomalina.
pdf>.
WRIGHT, S. Glomalin, a manageable soil glue. 2005. Disponível em: <http://invam.caf.wvu.edu/methods/mycorrhizae/glomalin_brochure.pdf>
ZAMBOLIM, L.; SIQUEIRA, J.O. Importância e potencial das associações micorrízicas para a agricultura. Belo Horizonte: EPAMIG, 1985. 36 p. (Documentos, 26).




